
近日🧘🏻♂️,楊武利教授課題組提出了利用光熱效應釋放一氧化氮(NO)氣體分子用於耐藥型腫瘤治療的新策略。通過將具有良好光熱效果的納米載體和熱敏感的NO供體結合🏄🏼♀️☯️,構建了一種新型NO納米發生器,實現了近紅外光照射下精準可控的NO釋放,再結合靶向分子,該納米平臺可有效靶向腫瘤部位同時逆轉腫瘤的多藥耐藥性🐉,從而增強化療效果🦸🏽♀️,為耐藥型腫瘤的治療提供了新途徑,對NO相關的疾病治療也具有重要意義🌈🚃。該工作最近發表在《先進功能材料》(Advanced Functional Materials)上🫳,詳見👩🏽⚕️:Ranran Guo, Ye Tian, Yajun Wang, and Wuli Yang*. Near-infrared Laser-Triggered Nitric Oxide Nanogenerators for the Reversal of Multidrug Resistance in Cancer. Advanced Functional Materials, 2017, 27, 1606398.
一氧化氮(NO)是人體內重要的氣體信號分子,它在血管平滑肌舒張,血小板黏附✒️,炎症和免疫反應,神經傳遞等多種生命活動中發揮著重要作用。近年來,利用NO這類氣體分子治療相關疾病被認為是一種新型的治療手段,具有廣闊的應用前景🤵♀️,然而🚶🏻♀️➡️,如何實現NO分子在體內的運輸以及準確的控製釋放仍然是一個巨大的難題👏。
為了解決這一問題,楊武利教授團隊構建了獨特的近紅外光響應的NO納米發生器。利用光熱試劑和熱敏感NO供體結合,在808 nm的近紅外光照射下👿,該納米平臺可以將光能有效轉化為熱能,從而促進熱敏感的供體釋放NO(圖 1)✊🏻。
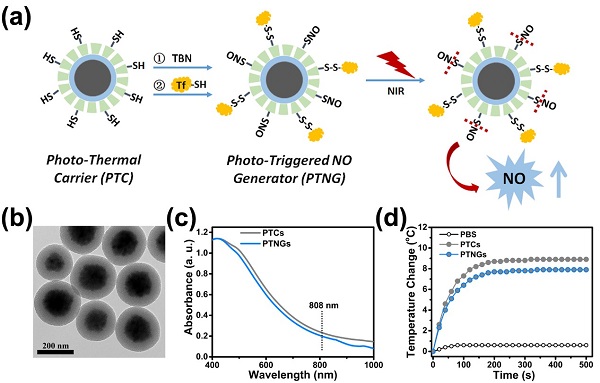
圖1. NO納米發生器的構建示意圖
他們在研究過程中發現, NO的釋放過程對近紅外光具有良好的響應👨🏻🏭🪳,在體外表現出明顯的off/on行為👰🏻,並利用激光共聚焦進一步在細胞水平上驗證了NO響應釋放的能力(圖2)🤸🏼;之後他們將該NO釋放平臺用於耐藥型癌症的治療。細胞實驗結果表明產生的NO分子能夠抑製耐藥型癌細胞的P型糖蛋白表達,從而有效提高細胞內化療藥物的富集,增強殺傷效果💁🏼♂️;在耐藥型腫瘤模型的裸鼠實驗中⚾️,這一結果被再次證實🖊,實驗組的腫瘤生長得到了有效控製🚰🏋🏼。這種近紅外光響應釋放NO的納米平臺對於耐藥型腫瘤和其它NO相關疾病的治療具有重要意義。
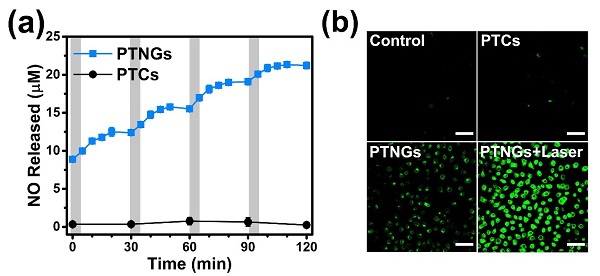
圖2. NO的釋放檢測: (a) 近紅外光照射下(808 nm, 0.3 W·cm-2, 5 min), NO釋放的off/on行為;(b) 利用熒光探針DAFDA檢測細胞內NO產生的激光共聚焦圖像🧑🏿🔧。